Responsable del laboratorio de Biología sintética e Ingeniería de Tejidos
Departamento de Bioingeniería e Ingeniería Química
La bioimpresión 3D es un área multidisciplinaria, en la cual convergen las ciencias de la vida y la ingeniería para poder crear tejidos y órganos, haciendo uso de los principios de la fabricación aditiva mediante la combinación de biomateriales, células y factores de crecimiento, que permitan el adecuado crecimiento celular. Los tejidos bioimpresos pueden abordar la escasez de modelos de tejidos funcionales para la medicina personalizada y el screening de drogas.
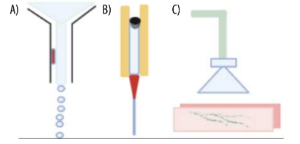
Los tipos de bioimpresoras mas usadas son: basadas en chorro de tinta, asistidas por láser y basadas en extrusión.
La bioimpresión por inyección de tinta implica aplicar una fuerza térmica, piezoeléctrica o electromagnética para provocar la liberación de pequeñas gotas de células encapsuladas en el biomaterial sobre una placa de recolección; para la deposición de capas delgadas y construcciones estampadas con alta resolución, esta técnica se puede usar con biomateriales de baja viscosidad.
La bioimpresión asistida por láser es menos utilizada debido a su baja disponibilidad, alto costo y complejidad. Sus principales beneficios están la alta viabilidad celular, la preservación de la mayoría de las funciones y morfologías celulares, así como el uso de una mayor densidad celular y al no usar boquillas, se evita la obstrucción de las mismas por la biotinta usada.
La impresión basada en extrusión, expulsa las biotintas a través de una boquilla ayudada por un émbolo empujado por una bomba al vacío que produce la presión necesaria para producir construcciones 3D capa por capa; lo que permite el uso de biotintas con mayor viscosidad.
En el espacio uno de los factores que está presente, es la microgravedad, la cual es aprovechada en bioimpresión dado que permite realizar geometrías más complejas, que no serían posibles en la tierra debido a la necesidad de soporte estructural por la gravedad; reduce los efectos del corte hidrodinámico y la presión hidrostática, haciendo que la tensión superficial sea la fuerza dominante; ocasionando que las moléculas permanezcan en esferas y películas apretadas, maximizando la atracción intermolecular.
Los efectos de la microgravedad en el proceso de bioimpresión son diferentes dependiendo de la tecnología usada; en la bioimpresión basada en inyección de tinta, la salida de las gotas y el flujo continuo del biomaterial por la boquilla se ven afectados por la microgravedad, debido a la menor velocidad con las que las gotas de biomaterial caen a la superficie. Las bioimpresoras 3D asistidas por láser requieren una limpieza total posterior al proceso de bioimpresión debido a los materiales residuales, dado que en las bioimpresoras 3D basadas en extrusión el sistema neumático extruye la biotinta mediante la boquilla de la impresora para dar forma a un filamento continuo, que de forma a la estructura final, por lo que se pueden usar en dirección ascendente en contra de la gravedad terrestre.
En tierra se han hecho muchos estudios previos simulando la microgravedad; usando por ejemplo; clinostato, máquina de posicionamiento aleatorio (RPM), recipiente de pared giratoria (RWV) y levitación magnética.
El Clinostato gira el sistema de estudio perpendicular al vector de gravedad para hacer que la aceleración gravitacional tienda a cero. Las máquinas de posicionamiento aleatorio (RPM) rotan las muestras biológicas a lo largo de dos ejes independientes para cambiar su orientación en el espacio de formas complejas para eliminar el efecto de la gravedad. Los recipientes de pared giratoria (RWV) están completamente llenos de un fluido y funcionan de manera similar a los clinóstatos al transferir la velocidad de rotación al sistema de estudio, los dispositivos de levitación magnética para la levitación del sistema, estos dispositivos son los más usados dado que no usan un sistema de rotación mecánico no producen fuerzas y estrés extra a la muestra.
En 2018, Rocosmos presentó «Organ.Aut», un bioensamblador magnético diseñado para investigar el potencial de la biofabricación 3D formativa de estructuras tisulares mediante el método de autoensamblaje de tejidos y órganos vivos en microgravedad. Las bandejas que crearon se sellaron con hidrogel termosensible para proteger esferoides de tejido cartilaginoso (condroesferas) en viajes desde la Tierra hasta la Estación Espacial Internacional. Para desencadenar la transición «gel-sol» del hidrogel termorreversible, primero se inyectó el medio paramagnético en el hidrogel que contenía las condroesferas. A continuación, la mezcla se enfrió a 17 °C durante 90 minutos, momento en el que las condroesferas quedaron libres para moverse. Seis cubetas que contenían las condroesferas se unieron en una construcción de tejido después de 1 hora en el campo magnético y se mantuvo a +37 °C durante 2 días. Luego, las condroesferas se volvieron a colocar en el suelo para un estudio adicional después de fijarlas en formalina al 4% y almacenarlas a temperatura ambiente durante 2 semanas. Los condrocitos pudieron mantener su vitalidad y actividad bioquímica, similar a los cultivos 3D en el suelo.
En 2019, se lanzó BioFabrication Facility (BFF) junto con los casetes del biorreactor de Techshot desde el ISS National Lab,teniendo como técnica de bioimpresión a la extrusión. Los casetes almacenarán el tejido producido. Para el proceso de bioimpresión diseñaron una plataforma con motores lineales con movimiento en los tres ejes aplicado al cabezal de impresión, este sistema tenía una resolución de 100 nm, una repetibilidad de 500 nm y una precisión de 1 μm. El primer experimento quería generar una estructura similar a tejido cardíaco, para lo cual se dispensaron 100 capas de biotinta, resultando en un volumen de construcción de ≈19,3 cm3.

Los principales retos que tiene la bioimpresión en el espacio es el alto costo de la logística necesaria para el embalaje y transporte (el costo puede variar de 4100 USD a 2700,000 USD por kilogramo de peso) para que las muestras lleguen viables a la ISS, también deben asegurar la seguridad de los astronautas que utilicen los dispositivos, por lo que las mangueras o cualquier dispositivo en donde se produzca paso de líquidos debe ser a prueba de fugas.
Para que las muestras biológicas permanezcan vivas, se necesitan diferentes temperaturas de almacenamiento preimpresión y luego de la impresión hasta su llegada a la tierra para estudios de viabilidad celular y moleculares.
Los componentes electrónicos y las muestras biológicas deben estar protegidos contra la radiación, dado que el nivel percibido de radiación ionizante equivalente a 6 meses en la ISS es de 80 mSv.
Conclusiones
Debido a la microgravedad, es posible bioimprimir estructuras empleando más sistemas fluídicos y, por lo tanto, biotintas más biocompatibles; Debido a que no hay gravedad, las geometrías complejas como vacíos, agujeros y túneles se pueden construir más fácilmente en microgravedad porque son autosuficientes allí en lugar de en la Tierra.
Bibliografía
- Tabury, K., Rehnberg, E., Baselet, B., Baatout, S., & Moroni, L. (2023). Bioprinting of Cardiac Tissue in Space : Where Are We ? 2203338, 1–15. https://doi.org/10.1002/adhm.202203338
- Rezapour Sarabi, M., Yetisen, A. K., & Tasoglu, S. (2023). Bioprinting in Microgravity. ACS Biomaterials Science and Engineering. https://doi.org/10.1021/acsbiomaterials.3c00195
- Parfenov, V. A., Petrov, S. V., Pereira, F. D. A. S., Levin, A. A., Koudan, E. V., Nezhurina, E. K., Karalkin, P. A., Vasiliev, M. M., Petrov, O. F., Komlev, V. S., Khesuani, Y. D., & Mironov, V. A. (2020). Scaffold-free, label-free, and nozzle-free magnetic levitational bioassembler for rapid formative biofabrication of 3D tissues and organs. International Journal of Bioprinting, 6(3), 110–119. https://doi.org/10.18063/IJB.V6I3.304