Profesor a Tiempo Completo
Departamento de Bioingeniería e Ingeniería Química
Las proteínas holina y endolisinas son responsables de la lisis durante la infección de la bacteria huésped por el bacteriófago. La endolisina realiza degradación de la pared células y es un tipo de enzima muralítica, mismas que se acumulan en el citosol durante la infección viral. Por otro lado, las holinas son proteínas de membrana de bajo peso molecular que se acumulan en la membrana en su forma plegada. Posteriormente, un mecanismo «programado» en el gen de la holina, hace a la membrana permeable de modo que la endolisina completamente plegada puede desencadenar la degradación de la pared. La endolisina destruye la mureína en un efecto de micro-explosión. La importancia de las proteínas holinas radica en que controlan el ciclo infectivo al señalizar la activación de los fagos líticos. La eficiencia de la infección depende del momento óptimo de esta señal. A la fecha se han reportado más de 30 grupos de holinas. Se han descrito muchos inhibidores de holinas, por lo que se conoce parte de su inicio de actividad y control negativo de la misma [1].
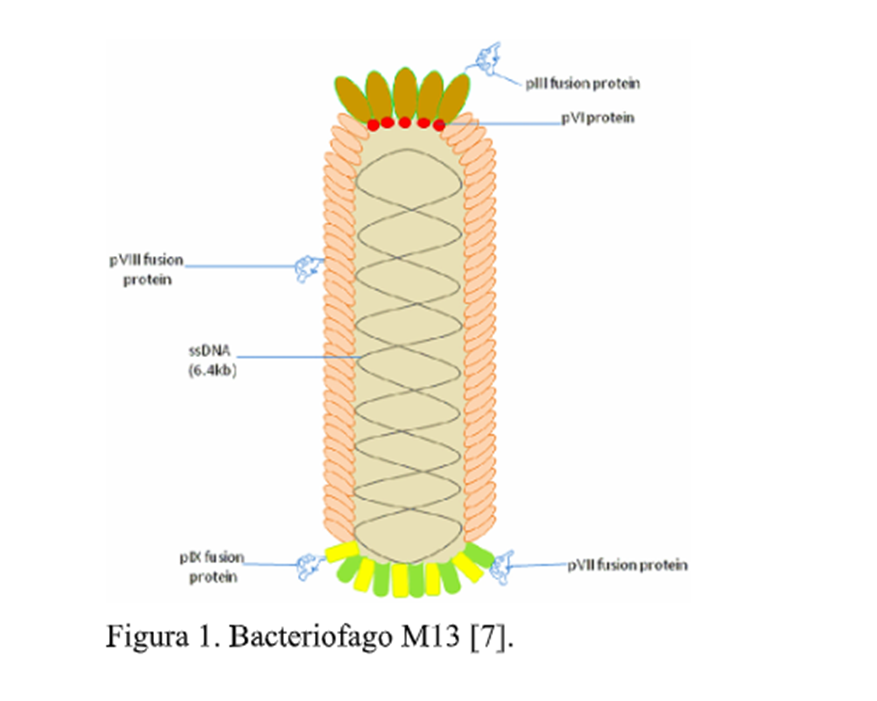
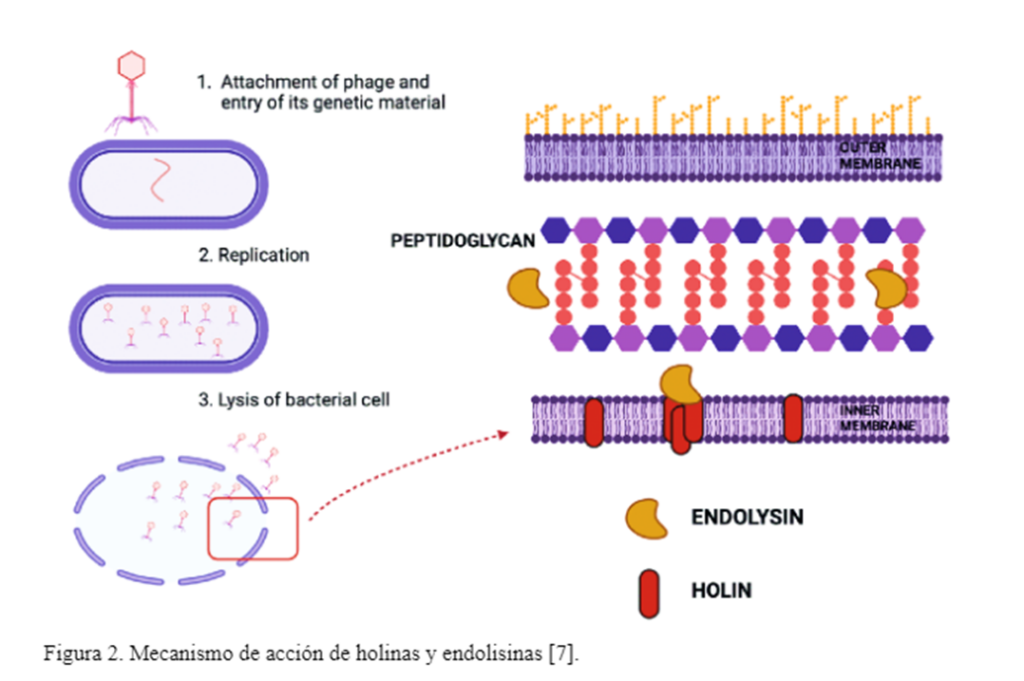
Las endolisinas y holinas son enzimas que los bacteriófagos utilizan durante su proceso lítico contra sus hospedadores, lo que ha llevado a un creciente interés en su aplicación contra bacterias multidrogo-resistentes como Salmonella infantis como alternativa a los antibióticos. Aunque poseen una notable actividad antibacteriana, su expresión y obtención en sistemas bacterianos presentan desafíos que deben resolverse para garantizar una producción eficiente. Las holinas, al expresarse recombinantemente, tienden a tener baja solubilidad debido a su naturaleza de proteínas de membrana, lo que resulta en la formación de cuerpos de inclusión que dificultan su adecuado plegamiento y purificación [2]. A pesar de superar estas limitaciones, ambas enzimas requieren un complicado proceso de ruptura celular y purificación para su aplicación [2]. En este contexto, el fago M13 podría ser una herramienta eficaz no solo para combatir bacterias MDR, sino también para facilitar la entrega de endolisinas y holinas. La sinergia entre el M13 y estas enzimas podría optimizar su acción antibacteriana y simplificar su producción. Cui et al. [4] emplearon esta técnica para expresar holinas de un bacteriófago de Pseudomonas aeruginosa en la capside del M13. Sus resultados mostraron un halo de inhibición significativo en el crecimiento de Pseudomonas aeruginosa en comparación al uso de la holina sin ser expresada en la cápside del bacteriófago. El sistema phage delivery con el bacteriófago M13, también se ha usado para expresar proteínas tóxicas como Gef y ChpBK, resultó en una reducción significativa de bacterias en la sangre de ratones infectados con E. coli. El ensayo CFU mostró una disminución progresiva en las bacterias viables, con reducciones de hasta 948 veces para Gef y 1579 veces para ChpBK [5]. En otro estudio presentado [6], se encontró que el fago M13 y su proteína g3p pueden ocluir el pilus conjugativo, esencial para la transferencia de genes entre bacterias. Al impedir la formación de pares conjugativos, el fago M13 reduce la eficiencia de la conjugación, limitando la propagación de genes de resistencia a los antibióticos. A diferencia de los antibióticos tradicionales, que pueden resultar ineficaces contra bacterias multidrogo-resistentes debido a sus mecanismos de resistencia, los fagos como M13 tienen la capacidad de introducir genes que codifican proteínas letales directamente en las bacterias. Esto puede provocar la muerte celular a través de mecanismos distintos a los que emplean los antibióticos, permitiendo eludir las vías de resistencia bacteriana.
Referencias Bibliográficas
[1] Wang IN, Smith DL, Young R. Holins: the protein clocks of bacteriophage infections. Annu Rev Microbiol. 2000;54:799-825. doi: 10.1146/annurev.micro.54.1.799. PMID: 11018145.
[2]Ž. Alaksandr et al., “Efficient matrix-assisted refolding of the recombinant anti-staphylococcal truncated endolysin LysKCA and its structural and enzymatic description,” Protein Expr Purif, vol. 174, p. 105683, Oct. 2020, doi: 10.1016/J.PEP.2020.105683.
[3] M. T. P. Gontijo, G. P. Jorge, and M. Brocchi, “Current Status of Endolysin-Based Treatments against Gram-Negative Bacteria,” Antibiotics 2021, Vol. 10, Page 1143, vol. 10, no. 10, p. 1143, Sep. 2021, doi: 10.3390/ANTIBIOTICS10101143.
[4] J. Cui et al., “Characterization of a lytic Pseudomonas aeruginosa phage vB_PaeP_ASP23 and functional analysis of its lysin LysASP and holin HolASP,” Front Microbiol, vol. 14, p. 1093668, Mar. 2023, doi: 10.3389/FMICB.2023.1093668/BIBTEX.
[5] Westwater, Caroline et al. “Use of genetically engineered phage to deliver antimicrobial agents to bacteria: an alternative therapy for treatment of bacterial infections.” Antimicrobial agents and chemotherapy vol. 47,4 (2003): 1301-7. doi:10.1128/AAC.47.4.1301-1307.2003
[6] Lin, Abraham et al. “Inhibition of bacterial conjugation by phage M13 and its protein g3p: quantitative analysis and model.” PloS one vol. 6,5 (2011): e19991. doi:10.1371/journal.pone.0019991
[7]A review on re-emerging bacteriophage therapy in the era of XDR . POOJA BHADORIYA1; RICHA SHARMA1; REKHA MEHROTRA1; SIMRAN KAUR1; ISHA SRIVASTAVA1; MUKUL JAIN2; PRASHANT KAUSHIK3 BIOCELL Tech Science Press, 2023 47(9): 1915-1930